基于人工智能的
药物制剂研发预测与监测
AI-Based.Prediction。and。Monitoring of Drug Formulation R&D
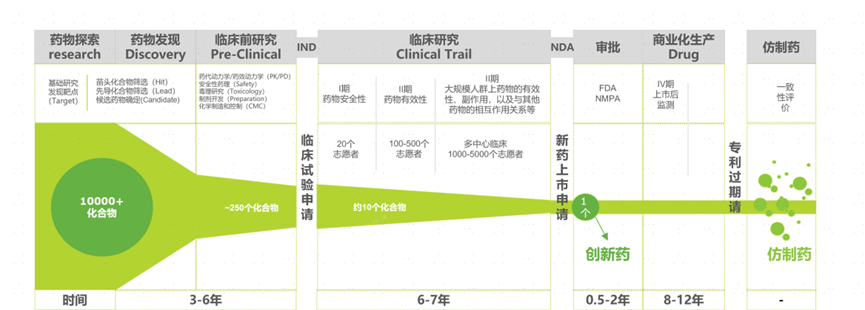
引言:新药诞生背后的“试验地狱”
当我们拿到一颗新药药片时,很难想象它的诞生需要经历多少次试验。对于固体制剂(如片剂)而言,从实验室研发到成品上市,研究人员往往要进行远超预期次数的实验,导致研发成本大幅飙升。为什么要做这么多实验?因为药物配方的微小改变都会影响药物的释放和吸收,尤其是药片在体外溶出(dissolution)的过程,其结果直接关系到药效和生物等效性。溶出曲线(药物随时间溶出的比例曲线)是衡量固体制剂质量的重要指标,但却充满不确定性。影响溶出速度的因素非常多,包括药物活性成分的特性、辅料配比、片剂硬度、溶出介质、搅拌桨转速等等。任何一个因素的变化都可能改变溶出曲线形状,因此溶出过程的结果往往难以靠经验准确预判。

更棘手的是,溶出试验既耗时又难以全程监控。一次标准的药物溶出度实验通常需要至少8小时。试验过程中,大部分时间药片都在介质中缓慢溶解,人不可能一直盯着观察。因此很多微观现象(例如药片崩解、表面侵蚀的细节)难以被实验人员完全捕捉。这意味着研发人员不仅要投入大量时间等待结果,还可能错过关键现象。同时,由于操作或环境等原因,每次实验的数据都有可能存在偏差甚至错误,需要重复验证。总之,在传统药物制剂研发中,高昂的试验成本和充满不确定性的溶出行为一直是令研究者头疼的难题 。
PART.01
传统方法的探索与局限
1
探索实验
面对溶出曲线的不可预知性,制药领域也发展出一些辅助预测工具和方法,希望减少盲目的试验。其一是经典的试验设计方法,比如正交试验设计:通过科学安排少量组合实验来近似模拟所有因素变化。然而,即便有设计优化,往往实际需要的实验次数仍然很多,有时甚至超过正交设计的水平。研究者只能不断试错调整配方,这依然费时费力。

另一个常用的是计算机模拟工具,如行业内广为使用的DDD Plus软件。
DDD.Plus [Dose..Disintegration..and..Dissolution..Plus]由美国Simulation Plus公司开发,被FDA等监管机构和众多药企用于体外模拟药物的溶出过程。听起来,它似乎可以在计算机上“试药”,那是不是意味着有了DDD Plus就不需要做实验了呢?现实并非如此。DDD Plus的使用非常复杂:用户需要手动输入大量参数,包括药物溶解度、粒径、晶型、介质条件等,然后软件利用内置数据库和模型计算溶出曲线。更麻烦的是,初始预测往往并不准确,还需要用一两个真实实验的数据来校正模型,才能得到勉强可信的结果。换言之,DDD Plus并不能凭空预测,它更像是一个需要喂入现成知识和实验结果的“辅助工具”。
2
局限性
造成这种局限的原因在于DDD Plus背后的算法模型。首先,参数繁多操作复杂,增加了实验人员的负担和试错成本。其次, DDD Plus主要依据线性回归等简单公式拟合溶出曲线。但真实的溶出行为往往是非线性的、复杂的,简单多项式趋势线无法科学地描述整个过程。再次,软件自带的数据库对配方中的辅料(非活性成分)覆盖有限。许多辅料是天然大分子,性质多变,超出了软件模型的适用范围。这意味着如果我 们的配方里有数据库未涵盖的新辅料,DDD Plus给不出可靠预测。归根结底,传统方法存在预测精度不足、数据需求量大、使用门槛高的问题。有研究尝试用人工神经网络(ANN)或其他机器学习(如支持向量机SVM)来预测溶出结果,但这些模型往往需要庞大的训练数据集,甚至比传统正交实验设计需要的实验次数还多。如果需要先做几十组实验来训练模型,那失去了减少实验的意义。由此可见,在AI介入之前,药物制剂领域一直缺乏一种既高效又准确的通用溶出预测手段。
PART.02
AI出手:药物制剂预测(PVP)系统登场
PVP(药物制剂预测)系统
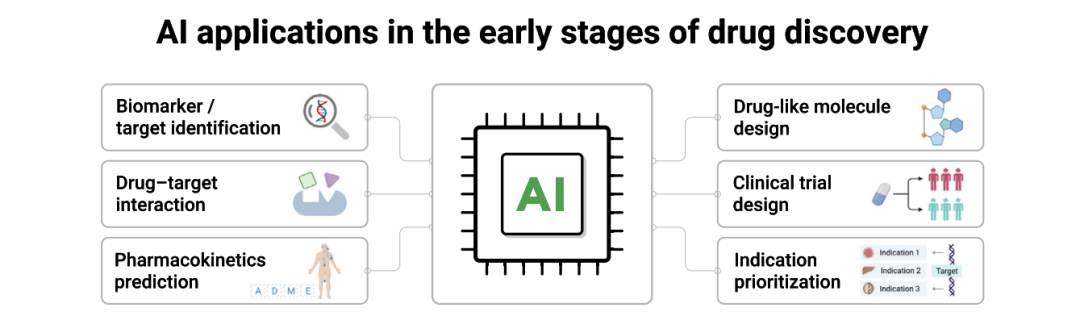
有没有可能让人工智能来当“实验预言家”,在做很少几次实验后就能预测出某配方的溶出曲线呢?Haoyu Wang的博士论文提出的正是这样一套PVP(药物制剂预测)系统,利用人工智能技术帮助研究人员“未卜先知”。这套系统的核心是一系列人工神经网络(ANN)模型,辅以创新的数据处理方法,实现对药物制剂溶出行为的智能预测和实时监控。
简单来说,研究人员先进行少量几组配方的溶出试验,把得到的数据喂给人工神经网络进行训练。这个ANN模型就像一个“学生”,从实验数据中学习配方成分与溶出曲线之间的关系。与传统模型不同,ANN不需要人为指定复杂公式,它通过大量简单“神经元”连接形成的网络自行拟合非线性关系,非常适合描述药物溶出这样复杂的过程。而且相比另一种机器学习算法SVM,ANN在处理大量数据时速度更快,更有利于将来扩展成“大数据”模型。
创新性成果
Haoyu Wang的系统不仅仅是拿现成的神经网络来用,而是在此基础上做了很多贴近制剂研发需求的改进。首先,它引入了一个新型的方程用于拟合药物动态溶解度曲线,取代了过去常用的多项式回归,提高了对非线性溶解过程的描述能力。其次,在预测片剂溶出速率方面,系统采用ANN模型进行预测,并创新性地加入两种非线性回归算法对预测结果进行处理 。正是这些改进,使得该系统达到两个令人瞩目的效果:所需实验数据量大大减少,预测精度显著提高。
研究结果
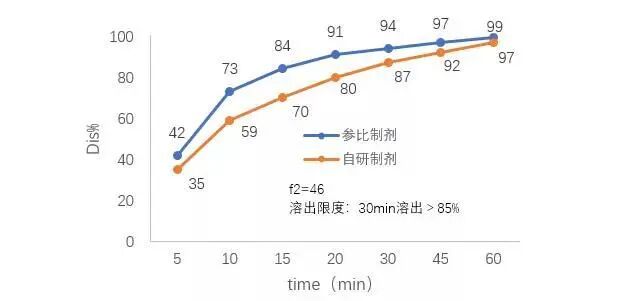
论文的研究结果显示,这套AI预测系统在保证精度的前提下,只需少量实验数据即可完成建模预测。具体而言,过去的研究模型大约需要29组不同配方的数据才能训练出可靠的预测模型,而该系统仅用6组配方试验的数据就成功绘制出高精度的溶出曲线!换句话说,AI帮忙省去了近80%的实验工作,却还能保证预测结果与真实实验高度吻合(评判溶出曲线相似度的指标F2值均大于50,达到监管要求)。这对于制药研发来说意义重大:大幅减少实验次数,就意味着节省时间和成本,加速新药配方的优化迭代。
PART.03
秘诀何在?小数据也能有大智慧
传统观点认为,机器学习往往“贪吃”数据,没有大量样本就难以训练出好模型。那么该AI系统是如何在小数据集上取得高精度的呢?秘诀在于巧妙的算法和数据处理策略,确保从有限的数据中榨取尽可能多的信息,并提高模型预测的稳定性和泛化能力。
No.1
智能筛选输入数据:

少量数据更容易受到偶然误差影响。该系统在模型训练前后都增加了数据筛选功能,剔除异常值对模型的干扰。具体做法是,先让模型用初始数据训练一次并预测结果,然后将预测曲线与原始实验数据对比,计算二者的相似度F2值。如果某组数据加入后导致预测结果偏差过大(F2低于设定阈值),系统会发出警示,研究人员可以据此排查并剔除有问题的实验数据。对于数据量较大的情况,系统甚至支持全自动筛选:设定好容许的F2范围,让程序自动删除可疑数据。这种数据筛查机制就像给模型入口加了一道“过滤网”,防止错误数据“毒害”模型。毕竟在实验操作中,一个平凡的失误(如取样时间误差、药片放置不当等)都可能产生离群数据,不加甄别地用于训练会降低预测可靠性。有了筛选功能,模型吃进去的都是相对“干净”的数据。
No.2
利用历史数据迁移学习

药物配方研发是个不断调整优化的过程。有时在一个基础配方上稍微改变辅料种类或比例,就需要重新做实验,之前的数据似乎浪费了。针对这一痛点,论文的AI系统提供了相关数据重用的设计。具体来说,模型输入采用了“预留因子位”的方法:把所有可能出现的辅料种类都作为网络输入参数,如果某次配方里没用到某个辅料,就把对应输入值设为0。这样一来,不同配方的数据就能放在同一模型里训练;即使配方成分略有增删,之前类似配方的旧数据仍可部分作为新模型的训练样本。这种设计实现了“小改方,大数据”的效果:每当配方微调时,无需完全推倒重来,模型可以站在已有数据“肩膀”上学习新配方。这解决了过去“一方一模”的局限,让每一份实验数据的价值都被最大化利用。
No.3
两大利器:EDRM与RLRM
或许有人会问,即使有上述措施,拿六七组实验数据训练一个神经网络,它就万无一失吗?实际上,用少数据训练ANN模型确实存在预测不稳定的问题—不同训练初始条件可能得到略有差异的模型,导致预测曲线抖动不够平滑,或者某些时间点偏离真实值。为此,研究者设计了两种新型的回归方法与ANN结合,专门用来提升预测结果的稳定性。它们名字有点拗口:EDRM(有效数据回归法)和RLRM(参考线回归法),但原理并不难理解。
01
EDRM(有效数据回归法):
简单来说, EDRM的思路是“重复多次预测,取其平均”。在这个方法中,系统会对同一批输入数据进行多次神经网络训练和预测。由于每次神经网络初始化权重不同,相当于从不同起点学习,同样的数据可能得到稍有差异的预测结果。EDRM将这些多次预测看作一组样本,通过统计学方法筛选出异常的预测。具体地,程序会计算所有预测结果的均值和标准差,如果某次预测在某个时间点上的溶出值偏离平均值超过1个标准差,就判定为异常予以剔除。这样的筛选可以滤除那些由于模型陷入局部最优解而产生的离群曲线。最后,系统对剩下的“正常”预测曲线再逐点取平均,得到一条平滑稳定的溶出预测曲线。打个比方,这有点像我们量体温时连测三次取平均,以减少一次测量误差的影响。EDRM让模型预测更趋于群体智慧的平均,避免被单次波动所误导。
02
RLRM(参考线回归法) :
RLRM在EDRM基础上更进一步,增加了“对照”的概念。它会选取一条已知可靠的溶出曲线作为参考(例如来自某一个实验配方的实测数据),把它看作“标准曲线” 。系统在多次训练预测中,每得到一条新的预测曲线,就立刻拿它与参考线进行比较,计算相似度F2。如果相似度低于预设值(论文中初设F2阈值为65,比监管要求50更严格),就认为该次预测偏差较大,可能又是“踩坑”了,于是丢弃这次预测结果。如此迭代,直到累积了一定数量(论文中设定50次)的高质量预测曲线,最后再对这些曲线取平均,得到最终预测。因为每次预测都和参考标准对比, RLRM相当于为模型预测增加了校准:只有那些与经验标准接近的结果才被接受。这样做的好处是,有望获得比EDRM更高的精度,尤其是在参考曲线选得好的情况下,预测曲线的形状和水平都更贴近真实。
两种方法各有千秋:EDRM胜在稳健,不需要额外信息就能提升模型稳定性,而RLRM如果拥有高质量的参考数据,则往往准确度更胜一筹。不过RLRM对参考数据依赖较大,如果参考选得不恰当反而可能引入偏差。在论文的实验中,研究者分别用EDRM和RLRM对模型进行了预测评估,结果两种方法都成功将预测曲线与真实曲线的相似度F2提高到了50以上,验证了其有效性。其中EDRM方法表现出非常好的稳定性,而RLRM在参考曲线选择合理时也取得了更高的精确度。更重要的是,有了这两大“法宝”,模型在仅有6组数据训练的情况下依然保持了对未知配方预测的可靠性,真正做到了“小数据,大作为”。
PART.04
实时监控:溶出现象的“电子眼”
除了预测溶出曲线,这套系统的另一个亮点是实时监控溶出过程的图像识别模块。正如前文提到,长达数小时的溶出实验中,人工时刻观察几乎不可能。论文中研究者开发了一套摄像头+图像分析的软件系统,相当于给溶出试验装上了“电子眼”。这个监控系统包含可见光/红外双模摄像头和红外光源,即使在黑暗环境也能拍摄清晰画面。通过图像识别算法,系统能够自动跟踪溶出杯中上下漂浮的药片,并计算其轮廓面积随时间的变化,从而绘制出药片体积变化曲线。无论是白天黑夜、不同颜色的药片,系统都能识别。换句话说,研究人员再也不用眼巴巴守着试验,到点取样的同时,电脑已经在默默“观看”并记录下药片的崩解、溶解动态。这不仅提供了宝贵的定量监测数据,还解放了人力,让实验过程更高效安全。
PART.05
应用前景:让药物研发更聪明高效
这套集预测与监测于一身的PVP系统展现了人工智能在制药工业中的巨大潜力。展望未来,我们可以期待以下应用前景:
加速新药配方开发:
在新药研发早期,就可利用AI预测系统对不同配方方案进行虚拟筛选,优先挑选出有希望达到理想溶出特性的配方再去做验证实验。这样研发人员不必盲目尝试大量组合,把资源聚焦在少数有潜力的方案上。对于时间和资金都极为宝贵的新药研发来说,哪怕减少一半以上的试验次数,都可能显著缩短研发周期、降低成本。
提升仿制药一致性评价效率:
仿制药开发需要证明与原研药在体内具有生物等效性,而溶出度是一项关键考察指标。使用AI预测系统,可以在实验室阶段就调整配方使溶出曲线逼近原研药,大幅减少来回调整的次数。当AI模型足够成熟时,甚至有望根据历史数据库直接给出优化配方的建议,指导配方工程师一步到位地设计出符合要求的仿制药配方。
构建行业溶出大数据库:
论文提出,如果能与制药企业合作建立大型溶出数据库,将使模型如虎添翼。想象一下,汇集大量药物和配方的数据后,AI可以不依赖新实验直接预测新配方的溶出表现。这类似于训练一个“药物配方界的AlphaGo”:它从无数前人经验中学习,在你给出新配方时立刻给出接近真实的溶出曲线。当然,这需要各公司愿意分享数据并克服商业机密的障碍。即便无法公开数据,各大药企也可以各自用内部历史数据训练自己的模型,用于内部研发决策。
智能实验室与实时监控:

随着5G和物联网技术的发展,未来的制剂实验室可以将这种AI系统与硬件设备联结起来,实现在线实时监控与分析。实验人员可以通过手机等终端实时查看溶出进展,AI自动分析异常状况,必要时及时报警或调整。这将提高实验的可控性和安全性,真正实现“无人值守”的智能化实验。更进一步,结合自动溶出取样装置、机器人操作臂等技术,有朝一日配方筛选实验可能全程自动完成——AI挑配方、机器人做实验、摄像头监控、AI再分析,研发人员只需下达指令和最后决策即可。
PART.06
总结
从论文《AI-Based.Prediction。and。Monitoring of Drug Formulation R&D》中可以看出,人工智能正逐步改变传统药物制剂研发的范式。从繁琐的试验堆砌到智能预测与精准监控相结合,我们看到了制药工业与计算智能融合的巨大潜能。这套PVP系统利用人工神经网络和创新算法,让机器从少量实验中学会“举一反三”,大幅降低了研发对反复试验的依赖。同时,图像识别监测保证了实验数据和现象的完整获取。对于研发人员来说,AI不再只是冷冰冰的工具,而更像是一个贴心的助手:既能出谋划策(预测溶出走势),又能勤勤恳恳看管实验。从新药开发到仿制药一致性评价,再到未来无人智慧实验室,AI赋能药物制剂研发的前景令人振奋。或许在不久的将来,我们将迎来“少做实验,多出新药” 的新时代—让创新药物以更快的速度、更低的成本惠及大众。未来已来,让我们拭目以待这场药物研发的智能革命。

|PVP业之先锋
|021-50565706


